
找答案
首页>高中化学>物质的分离考试题目
【简答题】
氨基甲酸铵(NH 2COONH 4)是一种白色固体,易分解、易水解,可用作肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下: 2NH 3(g)+CO 2(g)NH 2COONH 4(s) ΔH<0。 (1)如图所示装置制取氨气,你所选择的试剂是________________________。
 (2)制备氨基甲酸铵的装置如图13-7所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
(2)制备氨基甲酸铵的装置如图13-7所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
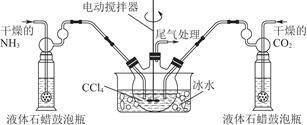 注:四氯化碳与液体石蜡均为惰性介质。 ①发生器用冰水冷却的原因是________________________________________________________________________________________________________________________________________________。 液体石蜡鼓泡瓶的作用是________________________________________________________________________。 ②从反应后的混合物中分离出产品的实验方法是________________________________________________________________________ (填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。 a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干 ③尾气处理装置如图所示。
注:四氯化碳与液体石蜡均为惰性介质。 ①发生器用冰水冷却的原因是________________________________________________________________________________________________________________________________________________。 液体石蜡鼓泡瓶的作用是________________________________________________________________________。 ②从反应后的混合物中分离出产品的实验方法是________________________________________________________________________ (填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。 a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干 ③尾气处理装置如图所示。
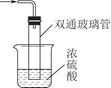 双通玻璃管的作用:____________;浓硫酸的作用:______________________、__________________________________________________________________。 (3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173 0 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸铵的物质的量分数为________。[M r(NH 2COONH 4)=78,M r(NH 4HCO 3)=79,M r(CaCO 3)=100]
双通玻璃管的作用:____________;浓硫酸的作用:______________________、__________________________________________________________________。 (3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173 0 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸铵的物质的量分数为________。[M r(NH 2COONH 4)=78,M r(NH 4HCO 3)=79,M r(CaCO 3)=100]
 (2)制备氨基甲酸铵的装置如图13-7所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
(2)制备氨基甲酸铵的装置如图13-7所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
 注:四氯化碳与液体石蜡均为惰性介质。 ①发生器用冰水冷却的原因是________________________________________________________________________________________________________________________________________________。 液体石蜡鼓泡瓶的作用是________________________________________________________________________。 ②从反应后的混合物中分离出产品的实验方法是________________________________________________________________________ (填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。 a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干 ③尾气处理装置如图所示。
注:四氯化碳与液体石蜡均为惰性介质。 ①发生器用冰水冷却的原因是________________________________________________________________________________________________________________________________________________。 液体石蜡鼓泡瓶的作用是________________________________________________________________________。 ②从反应后的混合物中分离出产品的实验方法是________________________________________________________________________ (填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。 a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干 ③尾气处理装置如图所示。
 双通玻璃管的作用:____________;浓硫酸的作用:______________________、__________________________________________________________________。 (3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173 0 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸铵的物质的量分数为________。[M r(NH 2COONH 4)=78,M r(NH 4HCO 3)=79,M r(CaCO 3)=100]
双通玻璃管的作用:____________;浓硫酸的作用:______________________、__________________________________________________________________。 (3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173 0 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.500 g。则样品中氨基甲酸铵的物质的量分数为________。[M r(NH 2COONH 4)=78,M r(NH 4HCO 3)=79,M r(CaCO 3)=100]参考答案:
登录免费查看参考答案
参考解析:
登录免费查看参考解析
知识点:
登录免费查看知识点
答题技巧:
登录免费查看答题技巧
被用于:
暂无被用于


刷刷题刷刷变学霸
相关题目:
【单选题】下列各组热化学方程式中,化学反应的△H前者大于后者的是( ) ①C(g)+O 2 (g )═CO 2 (g),△H 1 ; C(g)+ 1 2 O 2 (g)═CO(g ),△H 2 ; ②S(s)+O 2 (g )═SO 2 (g),△H 3 ; S(g)+O 2 (g)═SO 2 (g),△H 4 ; ③H 2 (g)+ 1 2 O 2 (g )═H 2 O(l),△...
【简答题】Fe、H2O、H2、O2、KMnO4五种物质,按要求写出反应的化学方程式.(1)两个化合反应:_________、___________(2)两个分解反应:_______、____________.
【简答题】人们对苯及芳香烃的认识是一个不断深化的过程. 请回答下列: ( 1)1866年凯库勒根据苯的分子式C 6 H 6 提出了苯的单键,双键交替的正六边形平面结构,解释了苯的部分性质,但有一些问题仍未能解决. 凯库勒结构不能解释的事实是 (填序号) A.苯能与氢气发生加成反应 B.苯不能使溴的四氯化碳溶液褪色 C.溴苯没有同分异构体 D.邻二溴苯只有一种结构 ( 2)苯和甲苯不容易与溴水发生加成反应,而...
【单选题】已知热化学方程式:SO 2(g)+ O 2(g) SO 3(g) △H =" ―98.32" kJ/mol,在容器中充入2molSO 2 和1molO 2充分反应,最终放出的热量为
【单选题】下列叙述中正确的是( )已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下:H2(g)+Cl2(g)=2HCl(g);△H=-Q1kJ/molH2(g)+Br2(g)=2HBr(g);△H=-Q2kJ/mol下列叙述中正确的是( )
【简答题】元素R的最高价氧化物化学式为RO2.它跟氢生存的化合物中含氢为25%,则R的相对原子质量为______,该化合物可燃,写出它燃烧的化学方程式______.
【简答题】把二氧化碳、一氧化碳、氮气的混合物依次通过:①炽热的炭层,②炽热的氧化铜,经充分反应后,最后得到的气体是______.此过程中发生反应的化学方程式为______,______.
【单选题】下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa): ① ② ③ ④ 由此判断,正丁烷的燃烧热是______。
【简答题】(7分).化合物C是医用功能高分子材料,可由化合物A(C 4H 8O 3)制得,如下图所示,B和D互为同分异构体。 试写出下列反应的化学方程式 A→B B→C 试写出下列反应的反应类型 A→B B→C A→D
【简答题】白磷在空气中燃烧的化学方程式______.

刷刷题刷刷变学霸